Zawartość

Jeśli już zmieszałeś ocet (który zawiera kwas etanowy) i wodorowęglan sodu, który jest zasadą, to widziałeś reakcję neutralizacji kwasowo-zasadową. Podobnie jak wodorowęglan i ocet, gdy kwas siarkowy jest mieszany z zasadą, oba zneutralizują. Ten rodzaj reakcji chemicznie nazywany jest neutralizacją.
cechy
Chemicy definiują kwasy i zasady na trzy różne sposoby, ale najbardziej użyteczna i dobrze znana definicja opisuje kwas jako substancję, która uwalnia jony wodoru, podczas gdy zasada je otrzymuje.mocne kwasy są lepsze do oddawania jonów, a kwas siarkowy jest zdecydowanie mocnym kwasem. Następnie po umieszczeniu w wodzie jest prawie całkowicie deprotonowany - w praktyce wszystkie cząsteczki kwasu oddały swoje dwa jony wodorowe. Darowane jony są wychwytywane przez cząsteczki wody, które po naładowaniu stają się cząsteczkami hydronium. Wzór na jon hydroniowy to H30 +.
Reakcja
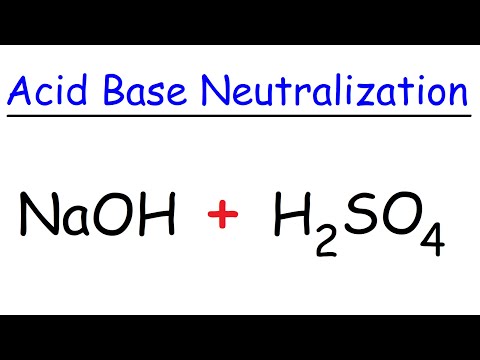
Gdy do kwasu siarkowego dodaje się zasadowy lub zasadowy roztwór, należy reagować i neutralizować. Baza usuwa jony wodoru z naładowanych cząsteczek wody, uwalniając wysokie stężenie jonów wodorotlenkowych. Te wraz z hydronium reagują, tworząc więcej cząsteczek wody i soli (produkt reakcji kwasowo-zasadowej). Ponieważ kwas siarkowy jest silny, może się zdarzyć jedna z dwóch rzeczy. Jeśli zasada jest również mocna, taka jak wodorotlenek potasu, otrzymana sól (na przykład siarczan potasu) będzie obojętna. Innymi słowy, ani kwasowy, ani zasadowy. Z drugiej strony, jeśli zasada jest słaba, taka jak amoniak, otrzymana sól będzie kwaśna, która działa jak słaby kwas (np. Siarczan amonu). Należy zauważyć, że ponieważ sól zawiera dwa jony wodoru, które można przekazać, jedna cząsteczka kwasu siarkowego może zneutralizować dwie cząsteczki zasady, takiej jak wodorotlenek sodu.
Kwas siarkowy i wodorowęglan sodu
Ponieważ wodorowęglan sodu jest często używany do neutralizacji wycieków kwasu z ogniw i akumulatorów lub w laboratoriach, reakcja kwasu siarkowego z wodorowęglanem jest typowym przykładem, który powoduje niewielkie niepowodzenie. Gdy wodorowęglan wchodzi w kontakt z roztworem kwasu siarkowego, przyjmuje jony wodoru i przekształca się w kwas węglowy, który może się rozkładać, uwalniając wodę i dwutlenek węgla. Jednak, gdy kwas siarkowy i wodorowęglan reagują, stężenie kwasu węglowego szybko się kumuluje, co sprzyja tworzeniu się dwutlenku węgla. Wrząca masa pęcherzyków tworzy się, gdy dwutlenek węgla wydostaje się z roztworu. Ta reakcja jest prostą ilustracją zasady Le Chatelliera - kiedy zmiany stężeń zmieniają równowagę dynamiczną, system reaguje w celu przywrócenia tej równowagi.
Kolejne przykłady
Reakcja między kwasem siarkowym a węglanem wapnia jest nieco podobna do reakcji z wodorowęglanem - dwutlenek węgla wydobywa się w postaci bąbelków, a powstająca sól to siarczan wapnia. W reakcji kwasu siarkowego z mocną zasadą, taką jak wodorotlenek sodu, powstanie siarczan sodu, podczas gdy kwas siarkowy w reakcji z tlenkiem miedzi utworzy niebieski związek zwany siarczanem miedzi (II). Kwas siarkowy jest tak silny, że można go nawet użyć do umieszczenia jonu wodorowego w kwasie azotowym, tworząc jon nitroniowy. Reakcja ta jest wykorzystywana do produkcji jednego z najsłynniejszych materiałów wybuchowych na świecie: Trinitrotoluenu lub TNT.


